生体をどう再現するか
―2次元モデル or 3次元モデル―
弊社が提供するMPSは、構造や培養次元の違いにより、主に2次元モデルと3次元モデルに分類されます。
―上皮層を作る―臓器と血管は、それぞれの細胞によって形成される界面を介して相互に物質輸送が行われています。2次元モデルでは、多孔質膜の上下に上皮細胞および血管内皮細胞を培養することで、この界面構造を模倣します。 従来のカルチャーインサートを用いたモデルとは異なり、微小流路内で培養を行うことで、流れの付与や培養環境の精密な制御が可能となります。これらの特長を活かし、より生体に近いモデルの構築を実現します。 | 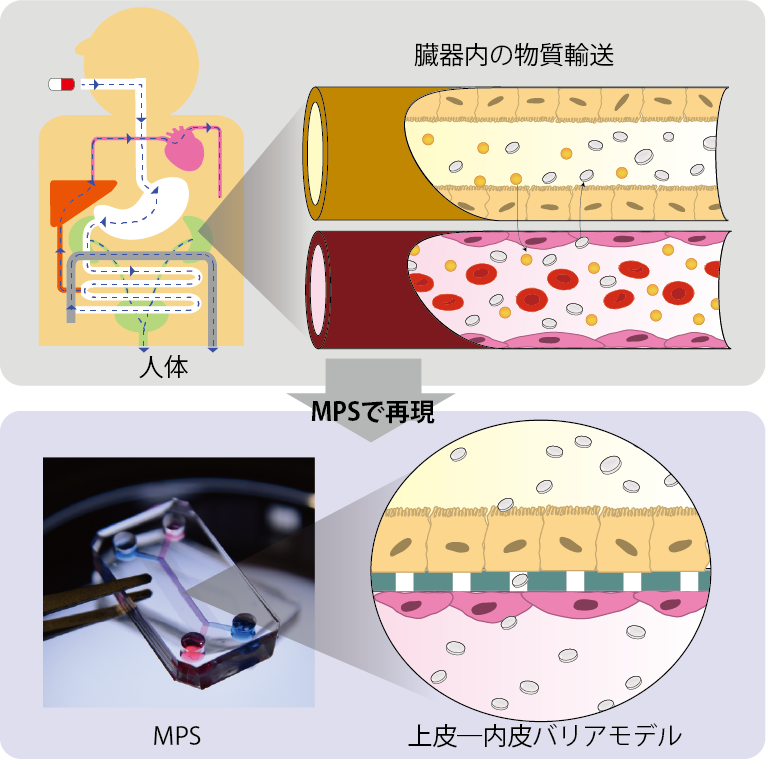 |
 | ―薬物動態・毒性評価へ―各臓器では、上皮‐血管界面を介して薬剤の代謝、吸収、排泄が行われます。これらの薬剤輸送を適切に評価することは、体内における薬物動態を高精度に予測するうえで極めて重要です。MPSを活用することで上皮細胞の高機能化を実現し、より予測精度の高いモデル構築を目指します。 また、2次元モデルでは、臓器側および血管側の双方から薬剤を暴露することが可能です。この曝露方向性の違いという特長を活かすことで、新規薬剤の毒性発現メカニズムをより詳細に解析することができます。 |
―血管網を繋ぐ―血管は、酸素や栄養の供給、ならびに老廃物の排出において不可欠な役割を担っています。さらに、血管は上皮細胞との相互作用を通じて、臓器機能の維持・向上に寄与しています。MPSチップを用いることで、スフェロイドやオルガノイドなどの三次元組織に血管を接続し、栄養や薬剤を効率的に供給することが可能となります。 | 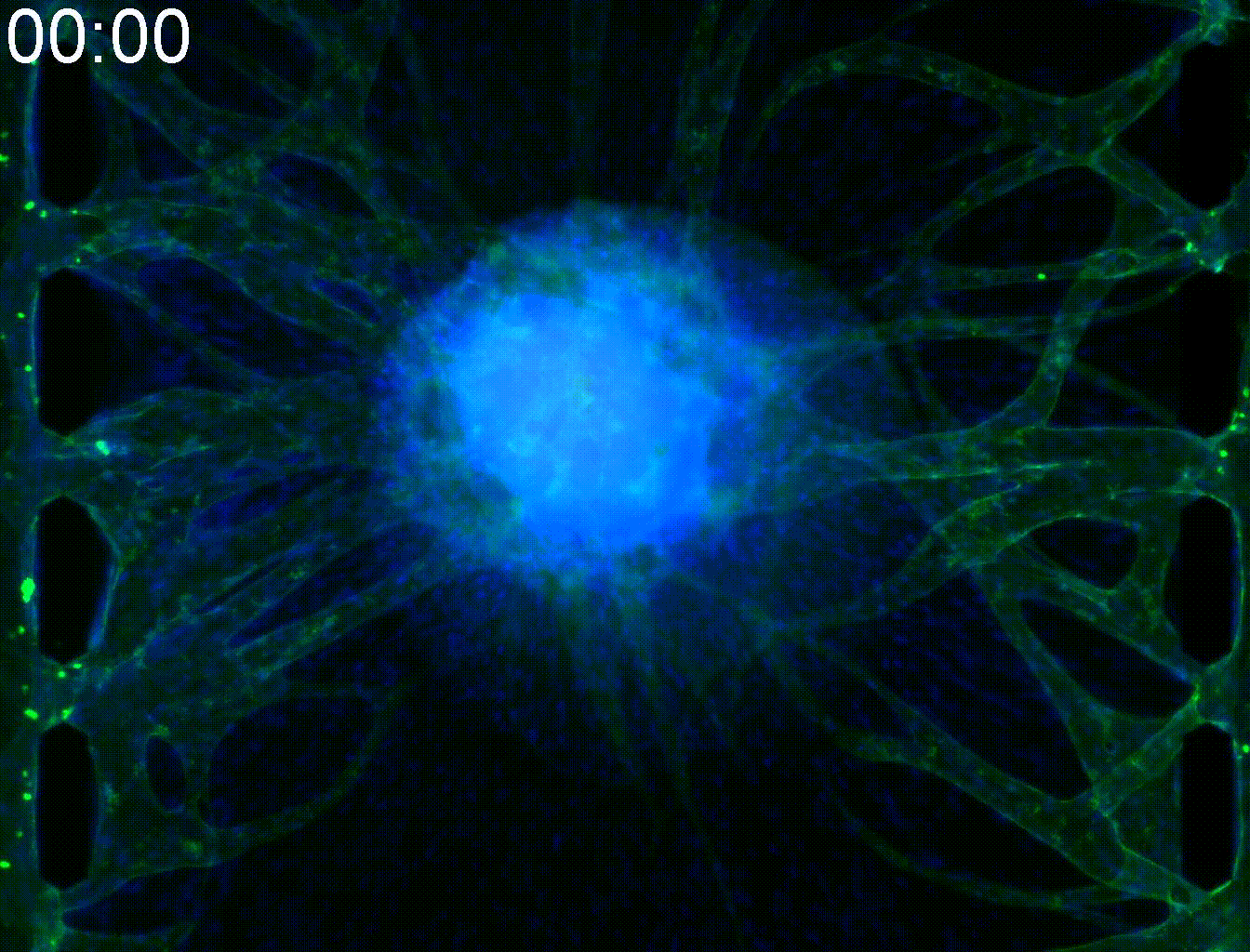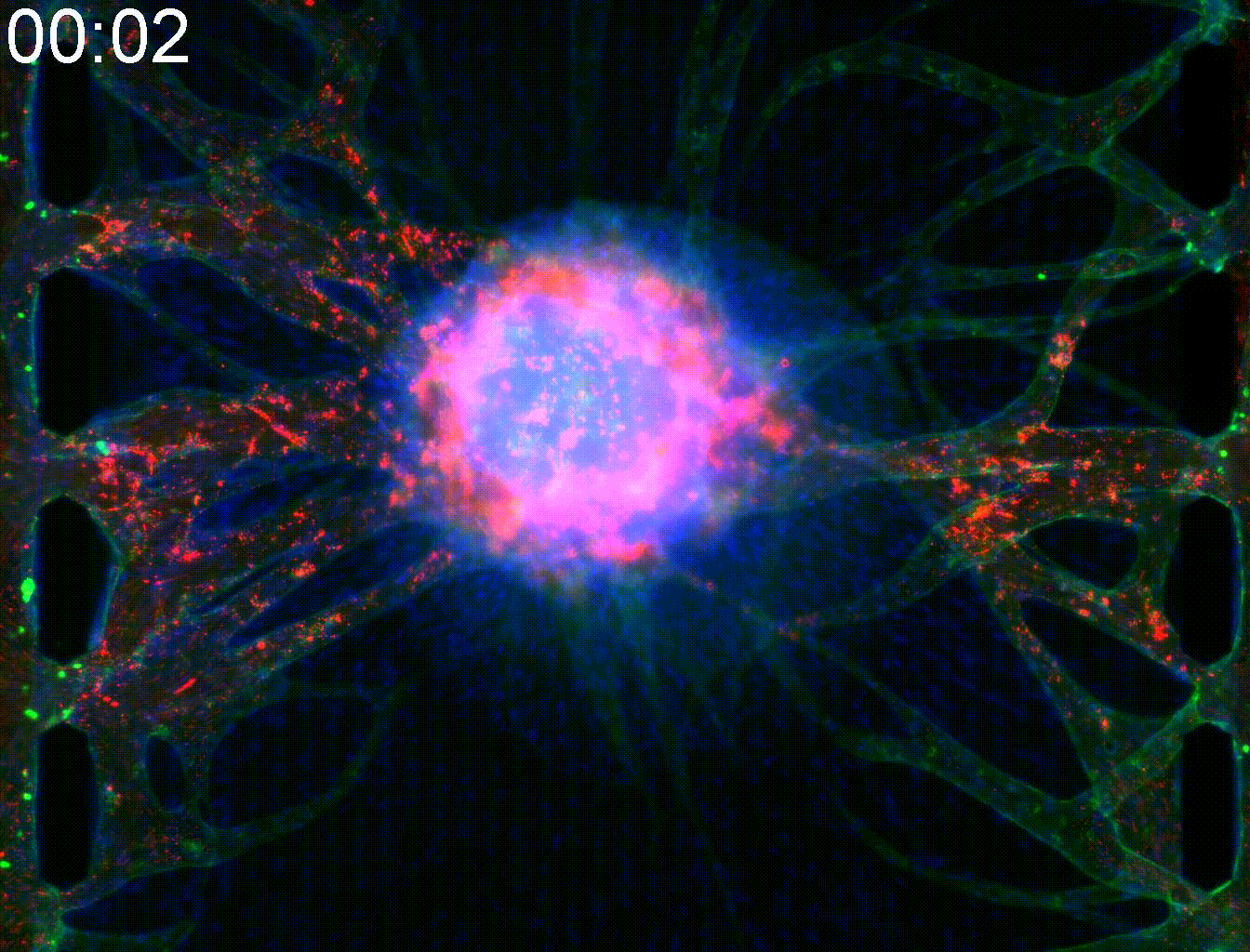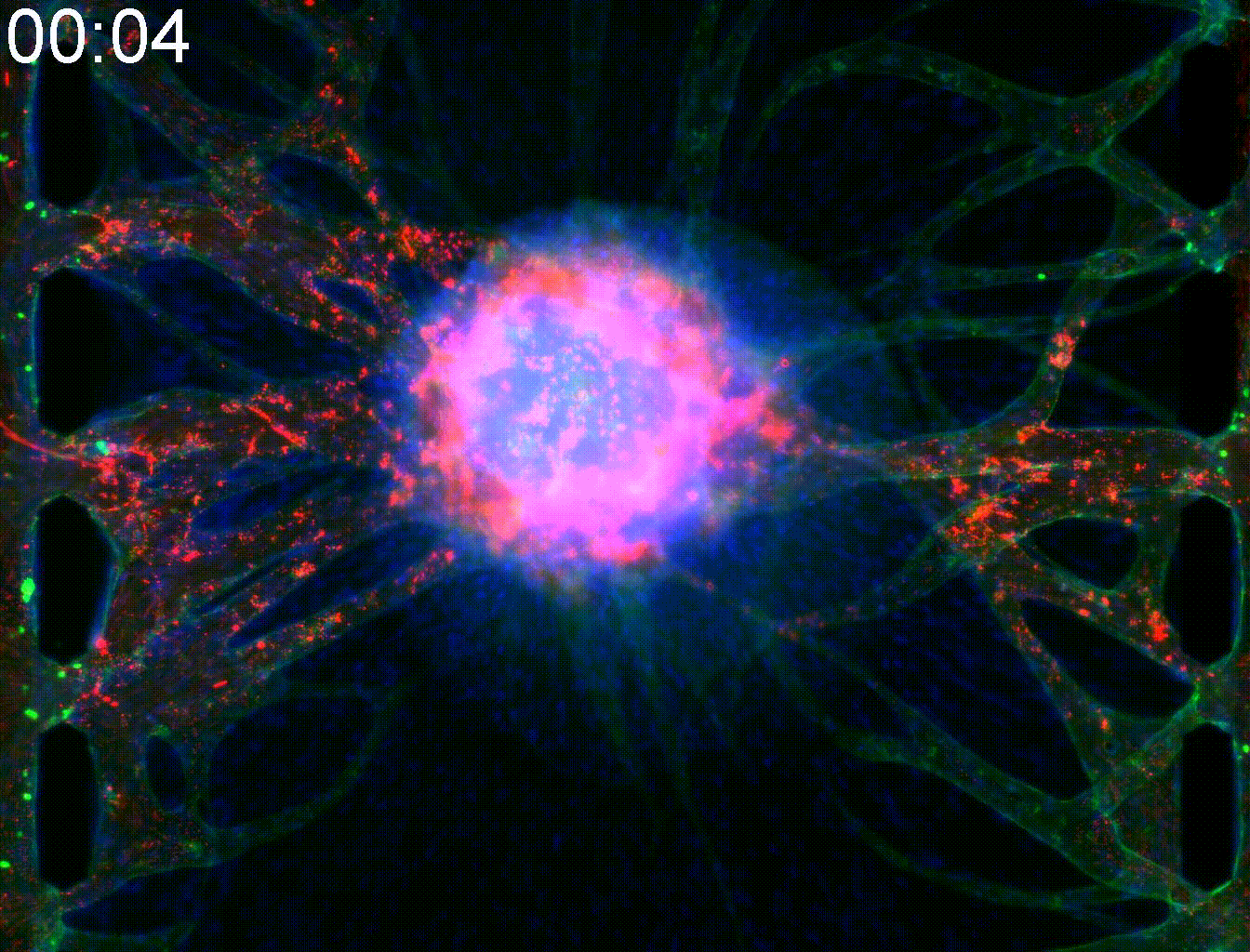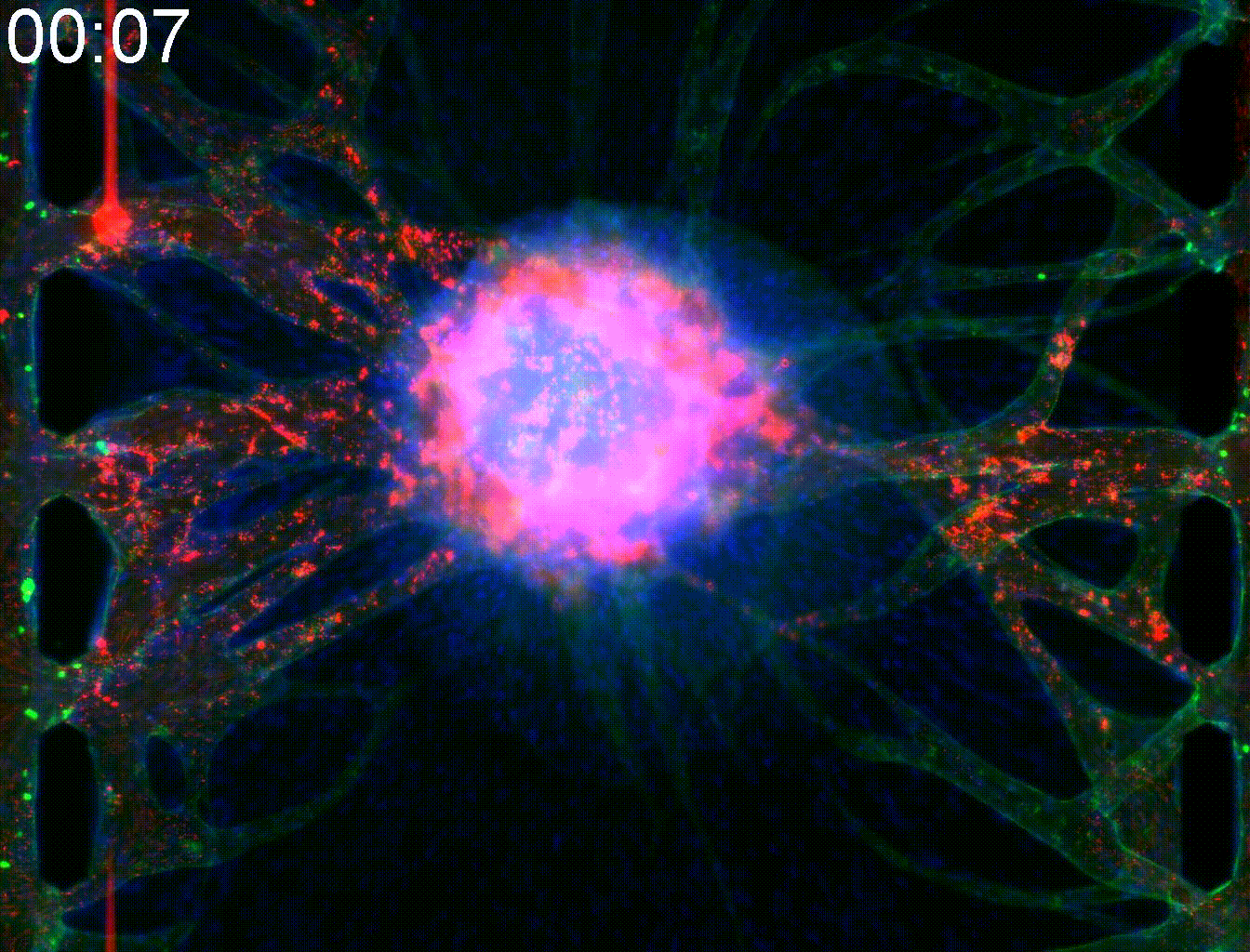 |
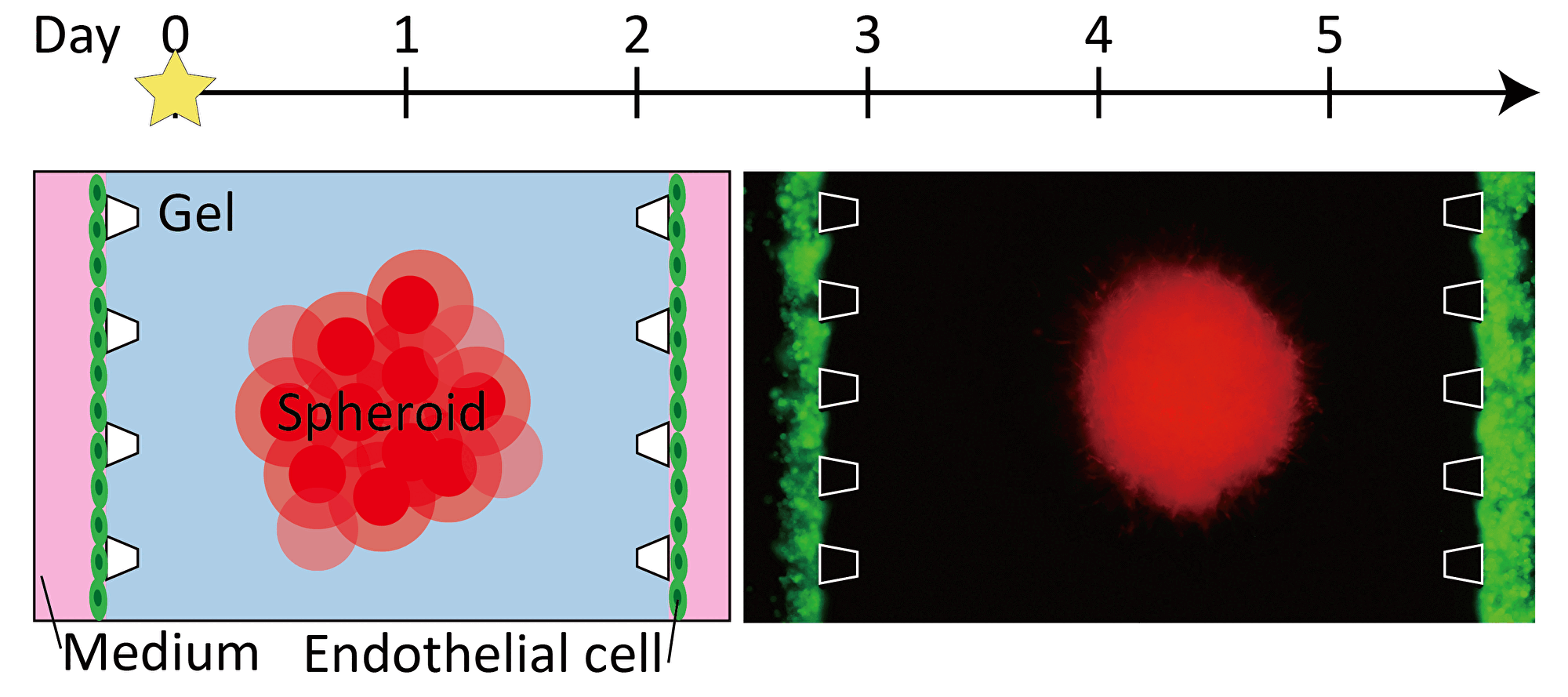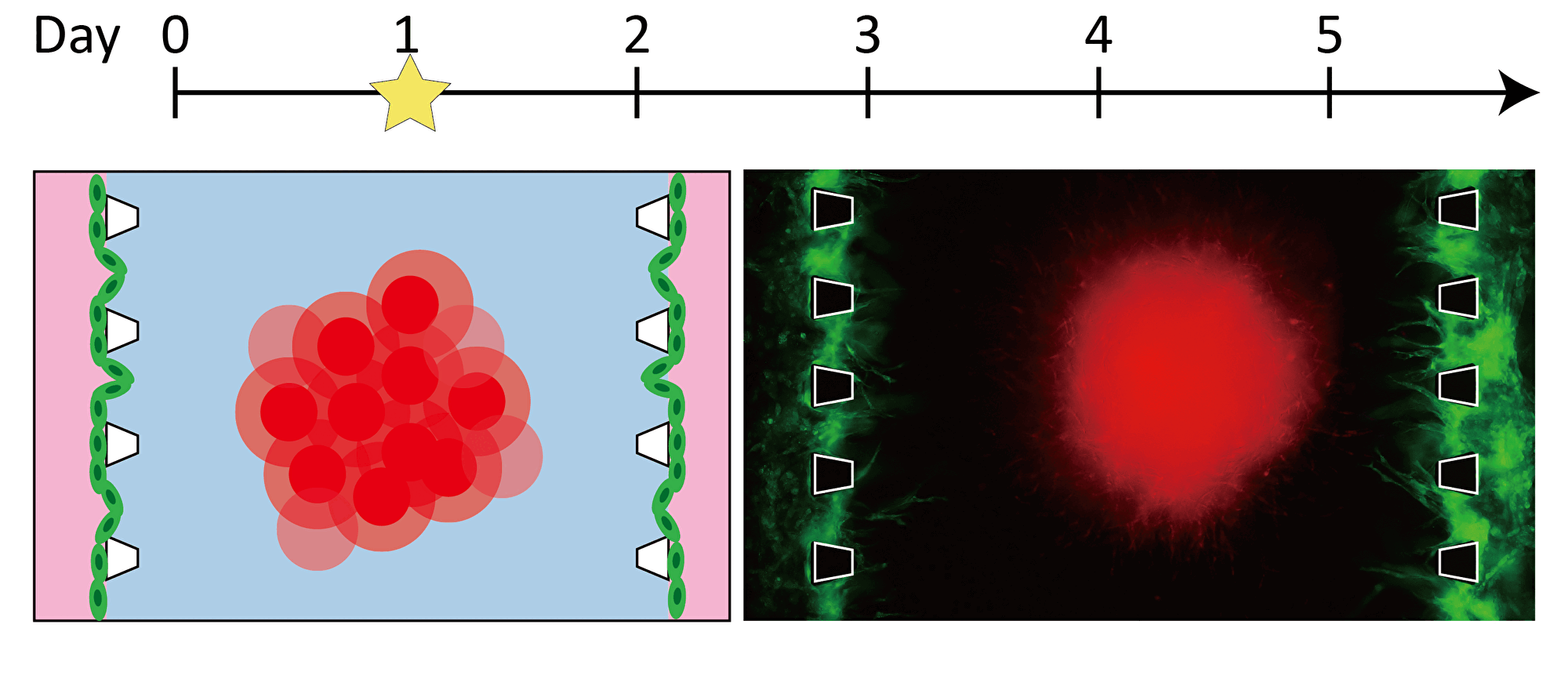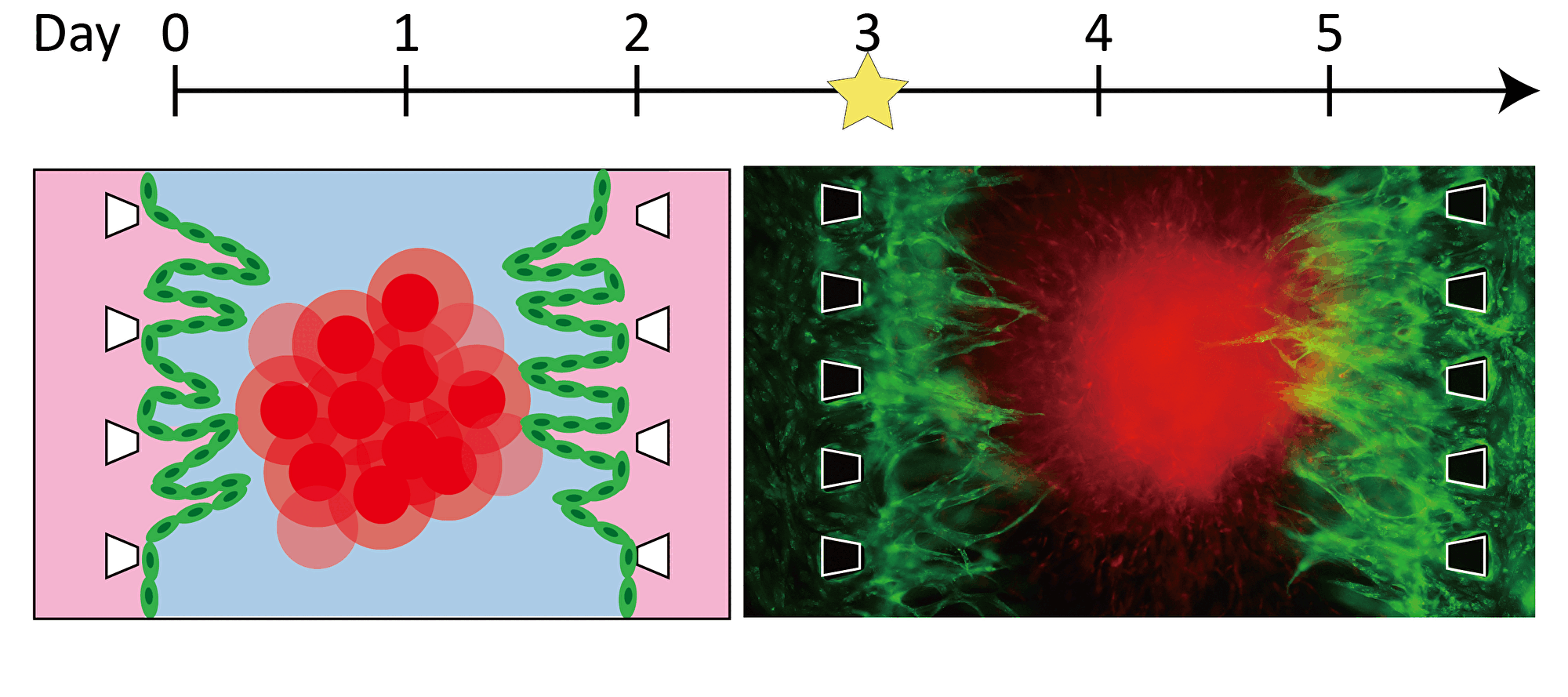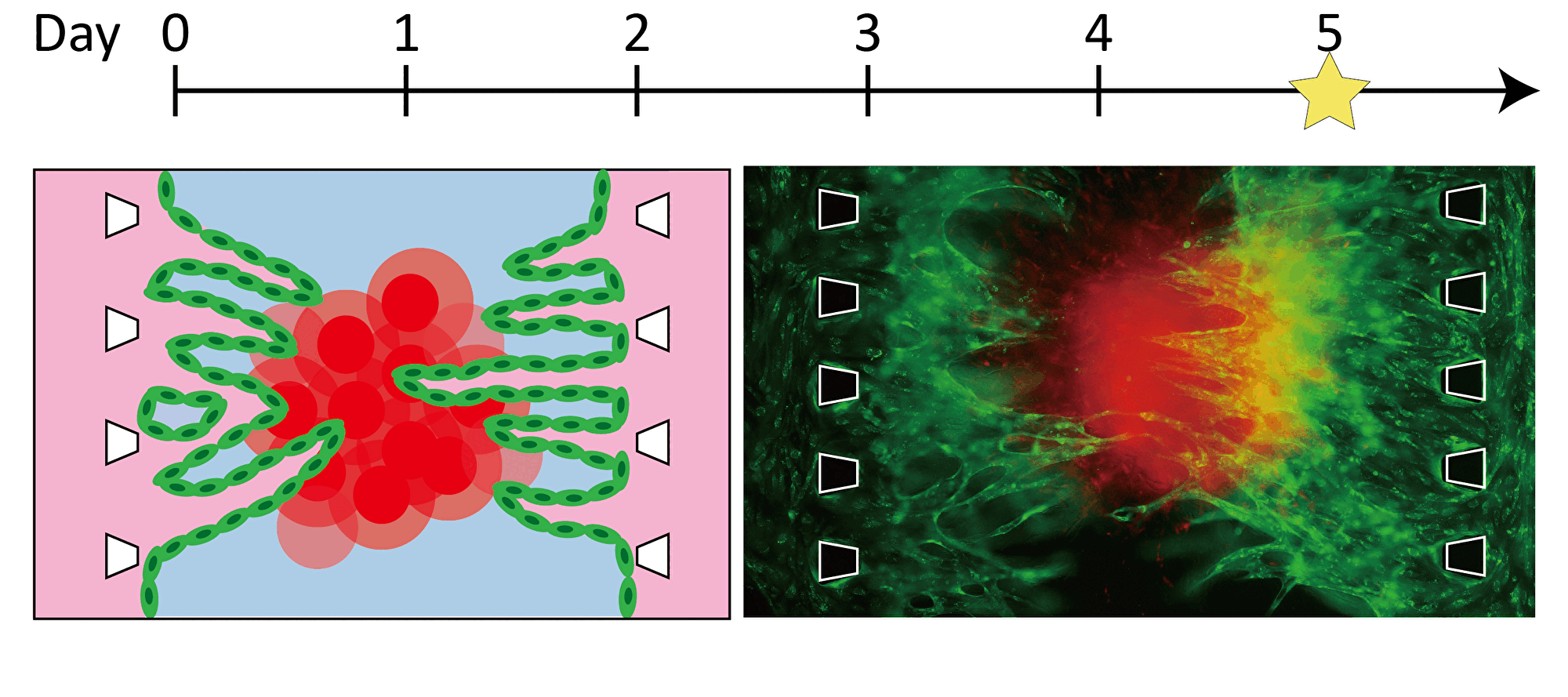 | ―血管を伸ばす―ピラーによって仕切られた三本の流路のうち,中央の流路にゲルと三次元組織を導入し、ゲルの界面に血管内皮細胞を接着させます。三次元組織から成長因子が分泌され、その濃度勾配に従い、新生した血管が三次元組織に向かって伸長していきます。血管の伸長の様子を定量化し、血管新生阻害剤などの薬剤の効果を評価できます。 |
―がん微小環境の構築へ―がん組織の周囲には、腫瘍血管や間質細胞を含む「がん微小環境」が存在し、がんの悪性化や薬剤耐性の形成に深く関与しています。MPSを用いて血管に加え、間質細胞や免疫細胞を導入することで、より複雑ながん微小環境も再現可能です。 | 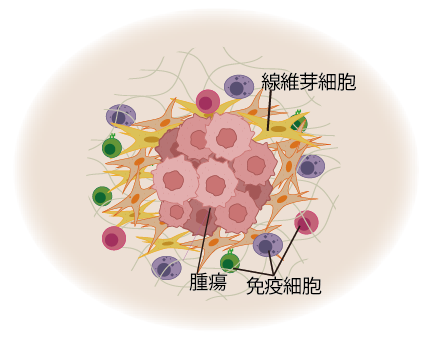 |
生体をどう再現するか
―2次元モデル or 3次元モデル―
弊社が提供するMPSは、構造や培養次元の違いにより、主に2次元モデルと3次元モデルに分類されます。
2次元モデル

―上皮層を作る―
臓器と血管は、それぞれの細胞によって形成される界面を介して相互に物質輸送が行われています。2次元モデルでは、多孔質膜の上下に上皮細胞および血管内皮細胞を培養することで、この界面構造を模倣します。
従来のカルチャーインサートを用いたモデルとは異なり、微小流路内で培養を行うことで、流れの付与や培養環境の精密な制御が可能となります。これらの特長を活かし、より生体に近いモデルの構築を実現します。
―薬物動態・毒性評価へ―
各臓器では、上皮‐血管界面を介して薬剤の代謝、吸収、排泄が行われます。これらの薬剤輸送を適切に評価することは、体内における薬物動態を高精度に予測するうえで極めて重要です。MPSを活用することで上皮細胞の高機能化を実現し、より予測精度の高いモデル構築を目指します。
また、2次元モデルでは、臓器側および血管側の双方から薬剤を暴露することが可能です。この曝露方向性の違いという特長を活かすことで、新規薬剤の毒性発現メカニズムをより詳細に解析することができます。
3次元モデル


―血管網を繋ぐ―
血管は、酸素や栄養の供給、ならびに老廃物の排出において不可欠な役割を担っています。さらに、血管は上皮細胞との相互作用を通じて、臓器機能の維持・向上に寄与しています。MPSチップを用いることで、スフェロイドやオルガノイドなどの三次元組織に血管を接続し、栄養や薬剤を効率的に供給することが可能となります。
―血管を伸ばす―
ピラーによって仕切られた三本の流路のうち,中央の流路にゲルと三次元組織を導入し、ゲルの界面に血管内皮細胞を接着させます。三次元組織から成長因子が分泌され、その濃度勾配に従い、新生した血管が三次元組織に向かって伸長していきます。血管の伸長の様子を定量化し、血管新生阻害剤などの薬剤の効果を評価できます。
―がん微小環境の構築へ―
がん組織の周囲には、腫瘍血管や間質細胞を含む「がん微小環境」が存在し、がんの悪性化や薬剤耐性の形成に深く関与しています。MPSを用いて血管に加え、間質細胞や免疫細胞を導入することで、より複雑ながん微小環境も再現可能です。
MPSモデルの実例
弊社は、京都大学・横川研究室における基礎研究で培われたノウハウおよびMPSモデルを基盤とし、バリデーションされたMPSモデルの構築・提供を進めていきます。
京都大学・横川研究室の技術
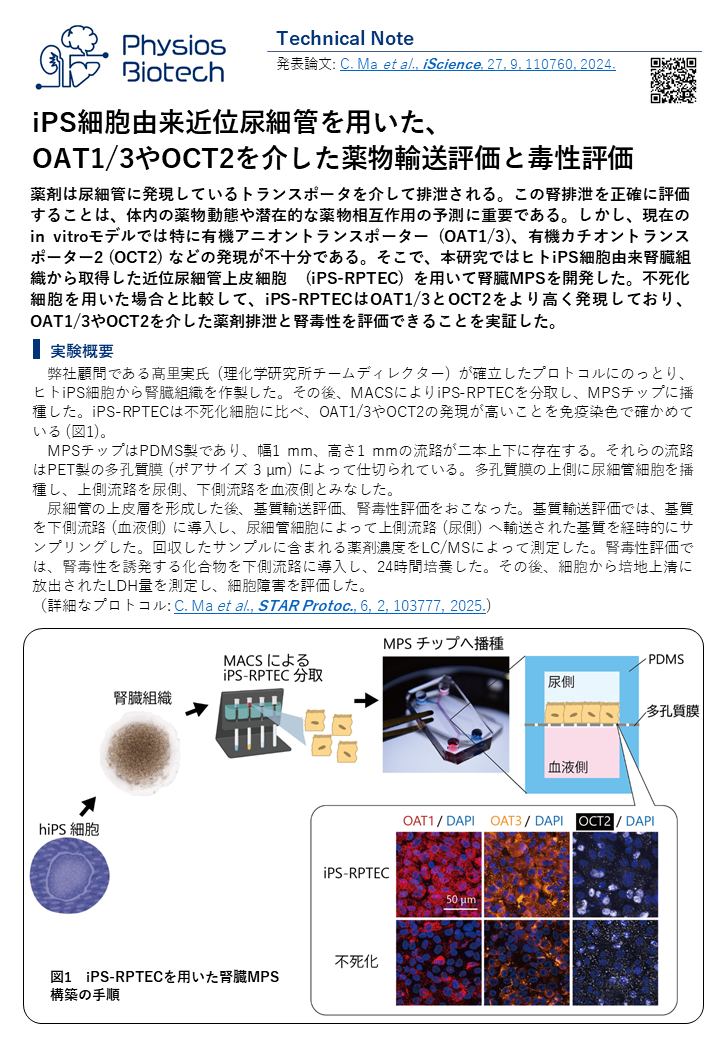
2次元モデル:iPS細胞由来近位尿細管を用いた、 OAT1/3やOCT2を介した薬物輸送評価と毒性評価
薬剤は尿細管に発現しているトランスポータを介して排泄されます。この腎排泄を正確に評価することは、体内の薬物動態や潜在的な薬物相互作用の予測に重要です。しかし、現在のin vitroモデルでは特に有機アニオントランスポーター (OAT1/3)、有機カチオントランスポーター2 (OCT2) などの発現が不十分でした。そこで、本研究ではヒトiPS細胞由来腎臓組織から取得した近位尿細管上皮細胞 (iPS-RPTEC) を用いて、腎臓MPSを構築しました。不死化細胞を用いた場合と比較して、iPS-RPTECはOAT1/3とOCT2をより高く発現しており、 OAT1/3やOCT2を介した薬剤排泄と腎毒性を評価できることを実証しました。
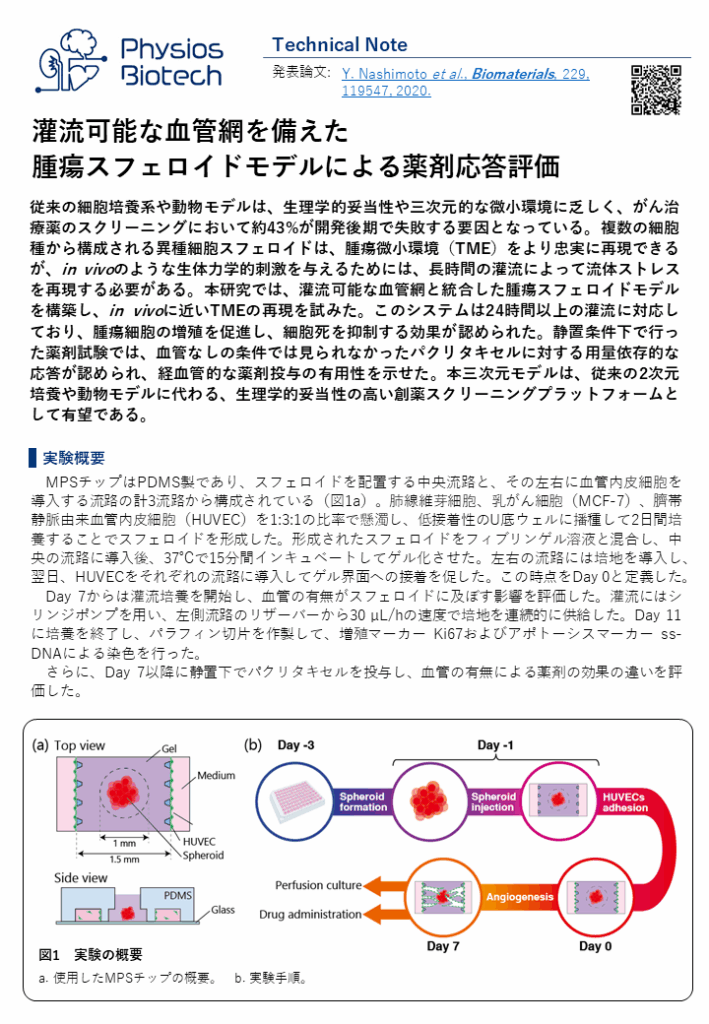
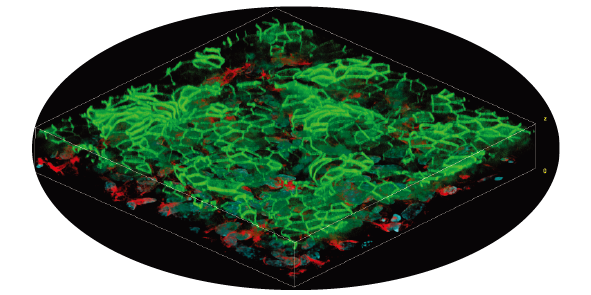
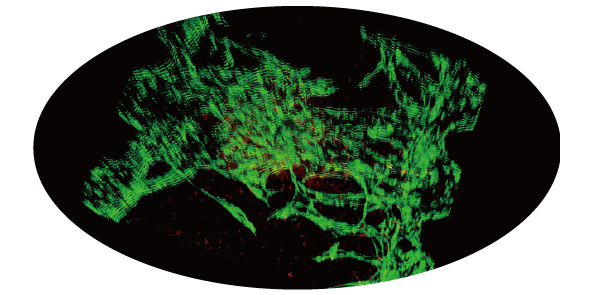
3次元モデル:灌流可能な血管網を備えた腫瘍スフェロイドモデルによる薬剤応答評価
従来の細胞培養系や動物モデルは、生理学的な妥当性や三次元的な微小環境に乏しく、がん治療薬のスクリーニングにおいて、約43%が開発後期で失敗する要因となっています。複数の細胞種から構成される異種細胞スフェロイドは、腫瘍微小環境(TME)をより忠実に再現することができますが、in vivoのような生体力学的刺激を与えるためには、長時間の灌流によって流体ストレスを再現する必要があります。
本研究では、灌流可能な血管網と統合した腫瘍スフェロイドモデルを構築し、in vivoに近いTMEの再現を試みました。このシステムは24時間以上の灌流に対応しており、腫瘍細胞の増殖を促進し、細胞死を抑制する効果が認められました。
また、静置条件下で行った薬剤試験では、血管のない条件では見られなかったパクリタキセルに対する用量依存的な応答が確認され、経血管的な薬剤投与の有用性を示すことができました。
本三次元モデルは、従来の2次元培養や動物モデルに代わる、生理学的妥当性の高い創薬スクリーニングプラットフォームとして有望であると考えられます。
3次元モデル:胞巣状軟部肉腫のオンチップモデルを用いた、 血管新生標的分子の評価
胞巣状軟部肉腫(Alveolar soft part sarcoma, ASPS)は血管やペリサイトを豊富に含む特殊な環境を形成し、全身に転移する予後不良な疾患です。従来の化学療法に対して耐性がある疾患であり、新たな治療法開発にはASPSの血管新生のメカニズムの解明が重要です。これまでの研究で、ASPSの原因遺伝子が細胞内輸送促進因子を制御し、特殊な血管構造を形成していることが分かってきました (M. Tanaka et al., Nat Commun, 2023)。本研究ではASPSスフェロイドと血管内皮細胞、ペリサイトを共培養する生体模倣システム (Microphysiological system, MPS) を開発し、ASPSによる血管新生を再現しました。これにより、ASPSによって血管網の透過性が上昇すること、細胞内輸送促進因子である Rab27a と Sytl2 が血管新生を誘導することを実証しました。
※ | 上記モデルは弊社のBoncyte Chipでバリデーションされていないモデルも含まれます。 |
 パイプライン
パイプライン
臓器
Context of use
チップ
実用化レベル
尿細管 (腎臓) モデル
薬物輸送評価、毒性評価
Boncyte Chip –Double Flow–
開発中